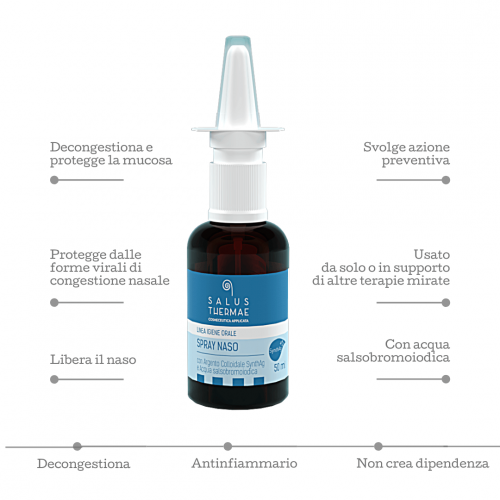
L’argento colloidale è un materiale che, anche inconsapevolmente, è stato utilizzato per centinaia di anni; studi analitici hanno infatti dimostrato che la semplice azione di inserire un pezzo di argento o di argenteria in semplice acqua, provoca il rilascio di ioni fino al raggiungimento di una concentrazione di 10 ppm.
Il progresso nella tecnica e la nascita della chimica, con tutte le scoperte seguenti, hanno successivamente portato ad una migliore comprensione ed un miglior controllo nella produzione e nell’utilizzo di questo materiale.
Di fondamentale importanza fu la scoperta del processo di sintesi del nitrato d’argento, il quale vanta la caratteristica di essere uno dei pochissimi sali solubili d’argento ed in ogni caso, l’unico veramente sicuro da utilizzare in un contesto produttivo o di laboratorio. Utilizzando il nitrato d’argento infatti si è riusciti ad avere delle polveri di argento metallico sempre più fini, fino a poi arrivare alle nanoparticelle.
Questa ricerca continua della dimensione dell’argento metallico via via sempre più piccola è dovuta al fatto che la funzionalità antimicrobica (quindi antibatterica, antivirale e antimuffa) è data dalla capacità del materiale di rilasciare ioni in numero sempre maggiore e con tempi sempre minori; per farlo si è lavorato sulle dimensioni, perché aumentando l’area superficiale totale del materiale, aumentava anche la capacità di emettere ioni Ag+.
L’emissione di ioni però non è stato l’unico problema di chi ha lavorato su questi materiali, infatti i colloidi di argento sono famosi per essere notevolmente instabili, ma andiamo a vedere meglio perché si destabilizzano.
Gli ioni d’argento, come noto da molto tempo, sono sensibili alla luce e con essa si riducono ad argento metallico (come noto dalle tecniche di sviluppo delle fotografie), il quale non potendo stare sospeso in acqua a dimensioni superiori da quelle nanometriche, collasserà in microparticelle, le quali poi si ritroveranno accumulate sul fondo del contenitore. Per ovviare a questo problema sono state inventate numerose tecniche, fra cui:
- La parziale ossidazione delle particelle colloidali ad ossido di argento, per aumentarne l’affinità con l’acqua.
- L’utilizzo di polimeri solubili per intrappolare in sospensione le particelle e creare fra loro una barriera in modo da non farle agglomerare e di conseguenza collassare (capping agent)
- L’utilizzo di diverse tecniche produttive, fra cui le più importanti sono la miscela di micro-polveri in solvente con filtrazione successiva, elettrolisi ad inversione di polarità con elettrodi di argento e riduzione flash in presenza di polimeri affini col materiale per impedirne l’agglomerazione.
 L’ultimo step dell’evoluzione di questo materiale, si basa sempre sul principio della riduzione delle dimensioni, e prende il nome di processo SynthAg.
L’ultimo step dell’evoluzione di questo materiale, si basa sempre sul principio della riduzione delle dimensioni, e prende il nome di processo SynthAg.
Con questo processo chimico-fisico si riesce a stabilizzare l’argento in soluzione dividendolo ione per ione all’interno di macrostrutture amorfe e dinamiche che possono prendere il nome di cluster amorfi.
Queste strutture, che possono raggiungere le dimensioni di 1 micron di diametro, sono come dei polimeri ad alto peso molecolare in cui l’argento è un monomero, ovvero un pezzetto del polimero che si ripete nella catena alternativamente ad un altro, fino ad arrivare ad un punto di chiusura della catena.
In questa forma gli ioni di argento rimangono stabili anche alla luce per lunghi periodi di tempo e ad alte concentrazioni.
Avendo qui gli ioni già separati uno ad uno, non abbiamo più bisogno di capire una percentuale ed un tempo di rilascio, in quanto tutto l’argento è già sotto forma di ione, per cui ha la massima funzionalità raggiungibile. Lo studio successivo si concentra sul mantenimento della stabilità di questo materiale nelle situazioni più difficili ed estreme, là dove sono richieste le sue funzioni.
I vantaggi di questa tecnica sono numerosi, infatti qui posso decidere a priori la concentrazione di ioni che servirà nel prodotto finale o nella situazione di utilizzo, avendo spazio libero per diluire, in più non si avranno problemi di annerimento o di pigmentazione dei punti di utilizzo, se utilizzato a basse concentrazioni, i quali sono sintomo di perdita di funzionalità, gli ioni infatti, una volta ridotti (annerendo o scurendo il punto di utilizzo) diventano argento metallico, via via sempre meno efficace.
Le concentrazioni di utilizzo sono raramente superiori alle 20/30 ppm, dal momento che già a 10 ppm si ha la completa distruzione di diverse forme di microorganismi, fra cui batteri e virus. Con i prodotti più tradizionali, per avere questa quantità di ioni, serve una concentrazione intorno all’1%, ovvero 10000 ppm.
In ultimo, ma non meno importante, l’argento non subisce fenomeni di batterio-resistenza, infatti esso riesce a penetrare le membrane dei microorganismi senza penetrare quelle delle cellule animali, essendo le prime di natura polare e le seconde di natura lipidica e molto più compatte, e va ad interrompere le principali funzioni metaboliche della cellula legando in modo irreversibile le ammine e i gruppi mercaptano (zolfo) fondamentali ai processi di respirazione cellulare. La morte del microorganismo avviene per soffocamento senza la lisi della membrana e l’argento viene successivamente riemesso dopo la decomposizione della cellula. Perché i microorganismi resistano all’argento, dovrebbero cambiare i fondamenti stessi della vita basata sul carbonio, che dovrebbero essere quindi diversi dall’essere proteine, carboidrati e lipidi.
 Arturo Sommariva
Arturo Sommariva
Chimico – Clusternanotech Ltd